Периодическая система химических элементов Д. И. Менделеева. Группы
Группами называют вертикальные колонки периодической системы химических элементов. В коротком варианте таблицы выделяют восемь групп. Номер группы совпадает с высшей валентностью химического элемента, которую он может проявлять в оксидах. Так, углерод, находясь в IV группе, проявляет в соединении с кислородом высшую валентность IV (CO2). Кальций же валентен II (CaO), так как находится во второй группе.
В коротком варианте таблицы каждую группу делят на две подгруппы — главную и побочную. В побочную подгруппу входят только элементы больших периодов — переходные металлы.

В длинном варианте периодической системы подгрупп нет, а количество групп равно 18.
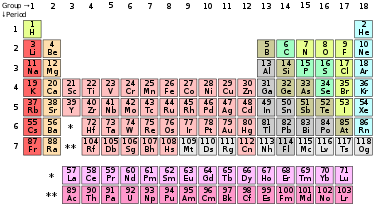
В коротком варианте таблицы группы обозначают римскими цифрами, а подгруппы буквами A (главная) и B (побочная). В длинном варианте группы обозначаются арабскими цифрами.
В подгруппах (рассматриваем короткий вариант) химические элементы имеют сходные свойства. Например, элементы подгруппы IA — это щелочные металлы, а подгруппы VIIA — галогены. Как известно, у всех щелочных металлов есть похожие свойства, галогены также сходны между собой. Однако в подгруппах свойства элементов закономерно изменяются сверху вниз (с увеличением относительной атомной массы). В главных подгруппах сверху вниз увеличиваются металлические свойства простых веществ соответствующих химических элементов. Неметаллические свойства соответственно убывают. Так, в подгруппе IIIA бор (B) не металл, а расположенный под ним в третьем периоде алюминий (Al) уже является металлом. В следующей главной подгруппе — IVA — неметаллами являются углерод, кремний и германий, а вот расположенные под ними олово и свинец — металлы.
В разных подгруппах одной группы свойства элементов различаются. Однако у них одинаковая высшая валентность, равная номеру группы.