Электронные оболочки атомов
Начиная со значения главного квантового числа n = 2, энергетические уровни (слои) подразделяются на подуровни (подслои), отличающиеся друг от друга энергией связи с ядром. Число подуровней равно значению главного квантового числа (номеру уровня), но не превышает четырех: 1-й уровень имеет один подуровень, 2-й - два, 3-й - три, 4-й - четыре подуровня. Подуровни, в свою очередь, состоят из орбиталей. Принято подуровни обозначать латинскими буквами, s - первый, ближайший к ядру подуровень каждого энергетического уровня; он состоит из s-орбитали, p - второй подуровень, состоит из трех p-орбиталей; d - третий подуровень, он состоит из пяти d - орбиталей; f - четвертый подуровень, содержит семь f - орбиталей. Таким образом, для каждого значения n имеется n2 орбиталей.
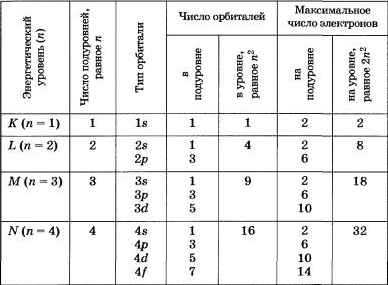
В каждой орбитали может находиться не более двух электронов - принцип Паули. Если в орбитали находится один электрон, то он называется неспаренным, если два - то это спаренные электроны. Принцип Паули поясняет формулу N = 2n2. В самом деле, если, например, на третьем уровне (n = 3) содержится 32 = 9 орбиталей, а в каждой орбитали по 2 электрона, то максимально число электронов составляет 2 * 32 = 18.
Из таблицы для первых четырех уровней показана связь главного квантового числа n с числом подуровней, типом и числом орбиталей и максимальным числом электронов на подуровне и уровне, а на схеме ниже дано подразделение энергетических уровней на подуровни.
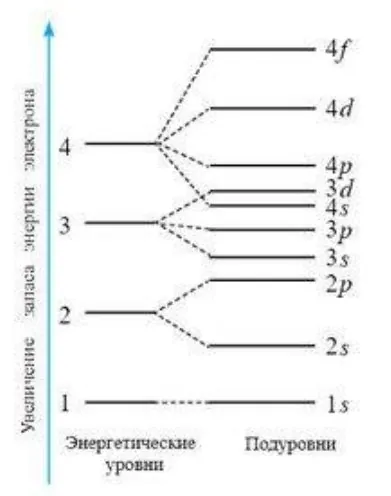
Из таблицы следует, что для характеристики электронов в атоме надо знать номер электронного уровня и типы орбиталей. Важно знать форму различных орбиталей (облаков). Это необходимо при изучении структуры молекулы.
В соответствии с теоретическими данными s-орбиталь обладает сферической симметрией, т.е. имеет форму шара. Примером может служить орбиталь атома водорода, n = 1. Такую орбиталь называют s-орбиталью. Электрон, который занимает s-орбиталь, называется s-электроном.
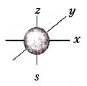
На 2-м энергетическом уровне (n = 2) имеется четыре орбитали, причем одна из них имеет сферическую симметрию. Она называется 2s-орбиталью. Очевидно, 2s-электрон обладает более высокой энергией, а потому будет находиться на большем расстоянии от ядра, чем 1s-электрон. Вообще, для каждого значения n существует одна сферическая симметричная орбиталь.
p-Орбиталь имеет форму гантели или объемной восьмерки. Все три p-орбитали расположены в атоме взаимно перпендикулярно.
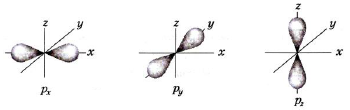
Они направлены вдоль осей пространственных координат, поэтому их часто обозначают как px- py- pz-орбитали. Такое обозначение указывает на пространственную направленность p-орбиталей. Если px-орбиталь расположена в направлении оси x, то, очевидно, px-электрон с наибольшей вероятностью находится вблизи оси x. То же можно сказать об орбиталях py и pz.
Следует отметить, что каждый энергетический уровень (слой), начиная с n = 2, имеет три p-орбитали. С увеличением n электроны занимают p-орбитали, расположенные на больших расстояниях от ядра, но направление по осям x, y, z всегда сохраняется. Еще более сложные формы, чем p-орбитали, имеют d-орбитали (их пять) и f-орбитали (их семь).