Ядерная модель строения атомов
До конца XIX в. атомы считались неделимыми. Затем, по мере накопления опытных данных, пришлось отказаться от такого взгляда и признать, что атомы имеют сложное строение. Новый взгляд подтверждался периодическим законом Д.И. Менделеева. Еще в 1871 г. Менделеев писал: "Легко предположить, что ныне пока еще нет возможности доказать... что атомы простых тел суть сложные вещества, образованные сложением некоторых еще меньших частей... Выставленная мной периодическая зависимость, по-видимому, подтверждает такое предчувствие".
На основе периодического закона Менделеева, экспериментальных исследований и особенно явлений радиоактивности быстро развивалось учение о строении атомов и молекул.
Для изучения строения атомов английский ученый Э. Резерфорд использовал большую проникающую способность α-частиц. Он наблюдал прохождение α-частиц (ядер гелия) через тонкие металлические пластинки толщиной приблизительно 10000 атомов.
При ударе об экран покрытый слоем сульфида цинка ZnS, α-частицы вызывают вспышку, что делает возможным подсчет числа частиц. Оказалось, что небольшая часть α-частиц, проходя через металлическую пластинку, отклоняется от своего пути на различные углы, а отдельные частицы резко меняют направление полета. Это явление известно под названием рассеяния α-частиц.
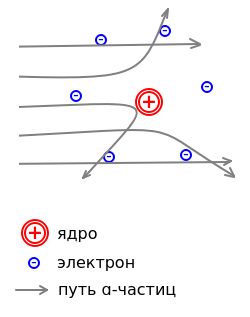
Резерфорд дал объяснение рассеяния α-частиц, предложив в 1911 г. ядерную модель строения атома. Согласно этой модели атом состоит из массивного положительно заряженного ядра, очень малого по размерам. В ядре сосредоточена почти вся масса атома. Вокруг ядра на значительном расстоянии от него вращаются электроны, образующие электронную оболочку атома.
Размер всего атома около 10-8 см, ядра - порядка 10-13 см, т. е. по размеру ядро примерно в 100000 раз меньше атома. Поэтому большинство α-частиц пролетает через атомы металлической пластинки на сравнительно больших расстояниях от их ядер и не отклоняется от своего пути. Однако часть α-частиц проходит близко от ядра, в результате возникают кулоновские силы отталкивания и частицы отклоняются. Те частицы, которые приближаются на достаточно малые расстояния к ядру, отклоняются еще более резко под действием тех же сил.
Ядерная модель атома сохранилась и в современных представлениях.
Поскольку атом в целом электронейтрален, то суммарный заряд электронов должен быть равен заряду ядра. Дальнейшие исследования показали, что положительный заряд ядра численно равен порядковому номеру элемента в периодической системе Менделеева.
Таким образом, число положительных зарядов ядра каждого атома, а также число вращающихся в поле ядра электронов равны порядковому номеру элемента.
Наиболее проста схема строения атома водорода (порядковый номер равен 1). Его ядро имеет одни элементарный положительный заряд, и в поле ядра вращается один электрон.
Ядро атома водорода - элементарная частица, которую называют протоном.