Периодичность свойств атомов
Такие свойства атомов, как их размер, энергия йонизации, сродство к электрону, электроотрицательность, степень окисления, связаны с электронной конфигурацией атома. В их изменении с увеличением порядкового номера элемента наблюдается периодичность.
Атомы не имеют строго определенных границ, что обусловлено волновой природой электронов. В расчетах пользуются так называемыми эффективными или кажущимися радиусами, т.е. радиусами шарообразных атомов, сближенных между собой при образовании кристалла. Обычно их рассчитывают из рентгенометрических данных.
Радиус атома - важная его характеристика. Чем больше атомный радиус, тем слабее удерживаются внешние электроны. И, наоборот, с уменьшением атомного радиуса электроны притягиваются к ядру сильнее.
В периоде атомный радиус в общем уменьшается слева направо. Это объясняется ростом силы притяжения электронов с ростом заряда ядра. В подгруппах сверху вниз атомный радиус возрастает, так как в результате прибавления дополнительного электронного слоя увеличивается объем атома, а значит, и его радиус.
Энергия ионизации - это энергия, необходимая для отрыва наиболее слабо связанного электрона от атома. Она обычно выражается в электрон-вольтах. При отрыве электрона от атома образуется соответствующий катион.
Энергия ионизации для элементов одного периода возрастает слева направо с возрастанием заряда ядра. В подгруппе она уменьшается сверху вниз вследствие увеличения расстояния электрона от ядра. Изменение энергии ионизации атома с ростом заряда ядра можно представить графически.
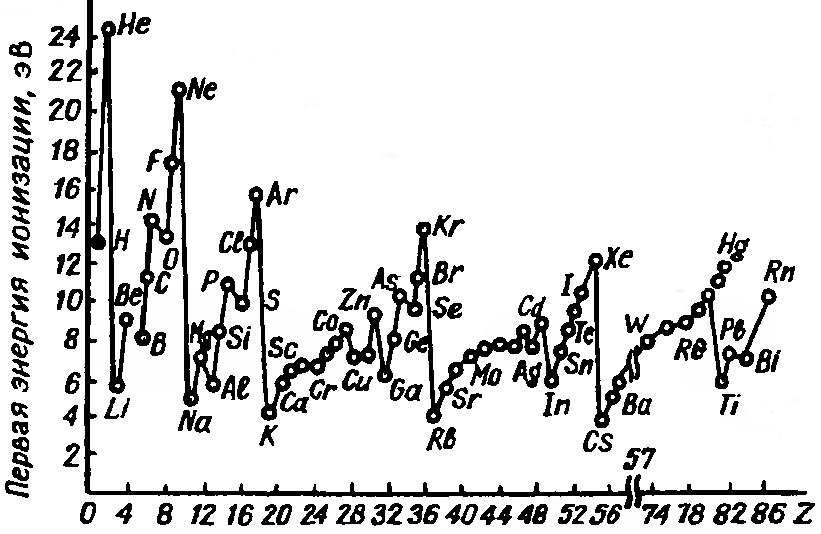
Энергия ионизации связана с химическими свойствами элементов. Так, щелочные металлы, имеющие небольшие энергии ионизации, обладают ярко выраженными металлическими свойствами. Химическая инертность благородных газов связана с их высокими значениями энергии ионизации.
Атомы могут не только отдавать, но и присоединять электроны. При этом образуется соответствующий анион. Энергия, которая выделяется при присоединении к атому одного электрона, называется сродством к электрону. Обычно сродство к электрону, как и энергия ионизации, выражается в электрон-вольтах. Значения сродства к электрону известны не для всех элементов; измерить их весьма трудно. Наиболее велики они у галогенов, имеющих на внешнем уровне по 7 электронов. Это говорит об усилении неметаллических свойств элементов по мере приближения к концу периода.
Определение электроотрицательности дал американский ученый Л. Полинг в 1932 г. Он же предложил и первую шкалу электроотрицательности. Согласно Полингу,
Электроотрицательность есть способность атома в соединениях притягивать к себе электроны.
Имеются в виду валентные электроны, т.е. электроны, которые участвуют в образовании химической связи. Очевидно, у благородных газов электроотрицательность отсутствует, так как внешний уровень в их атомах завершен и устойчив.
Для количественной характеристики предложено считать мерой электроотрицательности энергию, равную арифметической сумме энергии ионизации атома (I) и сродства к электрону (E), т.е.
X = I + E,
где X - электроотрицательность атома, а значит, и элемента.
В качестве примера определим X для фтора и лития. Из справочных таблиц найдем, что IF = 17,42 эВ, EF = 3,62 эВ, ILi = 5,39 эВ, ELi = 0,22 эВ (вычислено косвенным путем). Тогда XF = 17,42 + 3,62 = 21,04 эВ, а XLi = 5,39 + 0,22 = 5,61 эВ.
Фтор имеет наибольшее значение I + E, поэтому он является наиболее электроотрицательным элементом. Наименьшее значение электроотрицательности имеют атомы щелочных металлов.
Обычно электроотрицательность лития принимают за единицу и сравнивают с ней электроотрицательности других элементов. Тогда получают простые и удобные для сравнения значения относительной электроотрицательности элементов (будем их обозначать через x).
xLi = 1;
xF = 21,04 / 5,6 ≈ = 4 и т.д.
В настоящее время получила широкое распространение таблица относительных электроотрицательностей, при составлении которой использованы последние данные об электронном строении атомов и их радиусах.
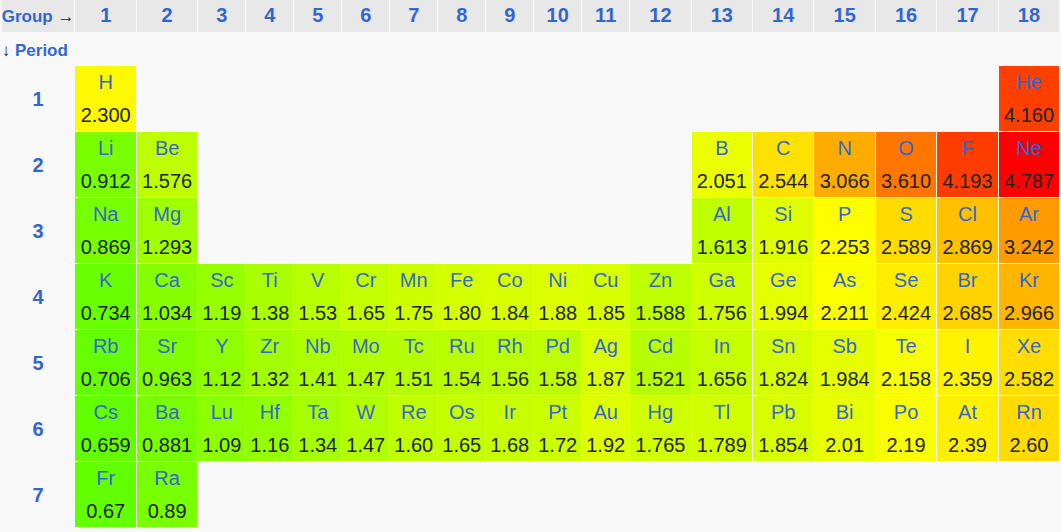
Необходимо отметить, что приводимые в разных книгах по химии значения относительной электроотрицательности несколько отличаются. Это объясняется тем, что они рассчитываются разными методами, исходя из определенных допущений и предположений.
Сопоставляя значения электроотрицательностей элементов от франция (0,86) до фтора (4,10), легко заметить, что относительная электроотрицательность подчиняется периодическому закону: в периоде она растет с увеличением номера элемента, в группе - уменьшается. Ее значения служат мерой неметалличности элементов. Очевидно, чем больше относительная электроотрицательность, тем сильнее элемент проявляет неметаллические свойства.
Из таблицы также видно, что неметаллы характеризуются большой относительной электроотрицательностью, а металлы - небольшой. При химическом взаимодействии элементов электроны смещаются от атома с меньшей к атому с большей относительной электроотрицательностью.