Теоретическое обоснование периодической системы элементов Д.И. Менделеева
Порядок заполнения электронами энергетических уровней (электронных слоев) и подуровней (подслоев) теоретически обосновывает периодическую систему элементов Д.И. Менделеева. Уже из рассмотрения электронных формул элементов первого и второго периодов легко сделать вывод, что период начинается элементом, в атоме которого на внешнем уровне находится 1s-электрон: в первом периоде это водород, в остальных - щелочные металлы. Завершается период благородным газом: первый - гелием (1s2), остальные периоды - элементами, атомы которых на внешнем уровне имеют электронную конфигурацию ns2np6.
Итак, первый период содержит два элемента: водород (Z = 1) и гелий (Z = 2). Второй период начинается элементом литием (Z = 3) и завершается неоном (Z = 10). Во втором периоде восемь элементов. Третий период начинается с натрия (Z = 11), электронная конфигурация которого 1s22s22p63s1. С него началось заполнение третьего энергетического уровня. Завершается оно у инертного газа аргона (Z = 18), 3s- и 3p-подуровни которого полностью заполнены. Электронная формула аргона 1s22s22p63s23p6. Натрий аналог лития, аргон - неона. В третьем периоде, как и во втором, восемь элементов.
Четвертый период начинается калием (Z = 19), электронное строение которого выражается формулой 1s22s22p63s23p64s1. Его 19-й электрон занял 4s-подуровень, энергия которого ниже энергии 3d-подуровня. Внешний 4s-электрон придает элементу свойства, сходные со свойствами натрия. У кальция (Z = 20) 4s-подуровень заполнен двумя электронами: 1s22s22p63s23p64s2. С элемента скандия (Z = 21) начинается заполнение 3d-подуровня, так как он энергетически более выгоден, чем 4p-подуровень. Пять орбиталей 3d-подуровня могут быть заняты десятью электронами, что осуществляется у атомов от скандия до цинка (Z = 30). Поэтому электронное строение Sc соответствует формуле 1s22s22p63s23p63d14s2, а цинка - 1s22s22p63s23p63d104s2. В атомах последующих элементов вплоть до инертного газа криптона (Z = 36) идет заполнение 4p-подуровня. В четвертом периоде 18 элементов.
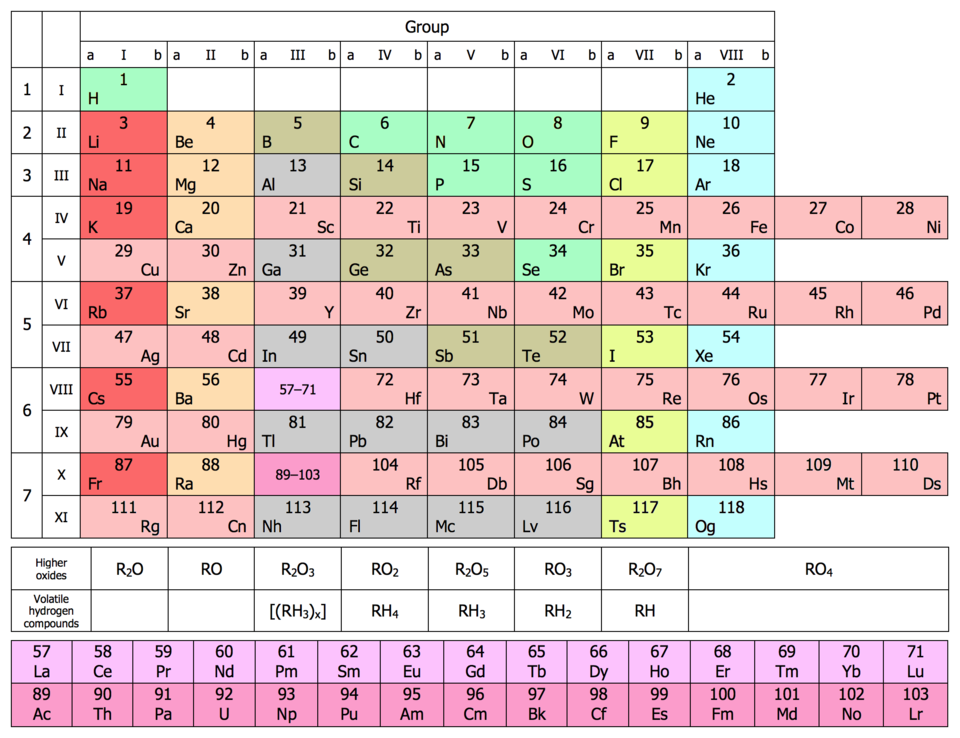
Пятый период содержит элементы от рубидия (Z = 37) до инертного газа ксенона (Z = 54). Заполнение их энергетических уровней идет так же, как у элементов четвертого периода: после Rb и Sr у десяти элементов от иттрия (Z = 39) до кадмия (Z = 48) заполняется 4d-подуровень, после чего электроны занимают 5p-подуровень. В пятом периоде, как и в четвертом, 18 элементов.
В атомах элементов шестого периода цезия (Z = 55) и бария (Z = 56) заполняется 6s-подуровень. У лантана (Z = 57) один электрон поступает на 5d-подуровень, после чего заполнение этого подуровня приостанавливается, а начинает заполняться 4f-подуровень, семь орбиталей которого могут быть заняты 14 электронами. Это происходит у атомов элементов лантаноидов с Z = 58 - 71. Поскольку у этих элементов заполняется глубинный 4f-подуровень третьего снаружи уровня, они обладают весьма близкими химическими свойствами. С гафния (Z = 72) возобновляется заполнение d-подуровня и заканчивается у ртути (Z = 80), после чего электроны заполняют 6p-подуровень. Заполнение уровня завершается у благородного газа радона (Z = 86). В шестом периоде 32 элемента.
Заполнение электронами электронных уровней седьмого периода аналогично шестому. После заполнения 7s-подуровня у франция (Z = 87) и радия (Z = 88) электрон актиния поступает на 6d-подуровень, после которого начинает заполняться 5f-подуровень 14 электронами. Это происходит у атомов элементов актиноидов с Z = 90 - 103. После 103-го элемента идет заполнение 6d-подуровня. Актиноиды, как и лантаноиды, обладают многими сходными химическими свойствами.
В зависимость от того, какой подуровень последним заполняется электронами, все элементы делят на четыре типа (семейства).
- s-Элементы; заполняется электронами s-подуровень внешнего уровня. К ним относятся первые два элемента каждого периода.
- p-Элементы; заполняется электронами p-подуровень внешнего уровня. Это последние 6 элементов каждого периода, кроме первого.
- d-Элементы; заполняется электронами d-подуровень второго снаружи уровня, а на внешнем уровне остается один или два электрона (у Pd - нуль). К ним относятся элементы вставных декад больших периодов, расположенных между s- и p-элементами (их также называют переходными элементами).
- f-Элементы; заполняется электронами f-подуровень третьего снаружи уровня, а на внешнем уровне остается два электрона. Это лантаноиды и актиноиды.
В периодической системе s-элементов 14, p-элементов 30, d-элементов 35, f-элементов 28. Элементы одного типа имеют ряд общих химических свойств.
Итак, периодическая система Д.И. Менделеева является естественной классификацией химических элементов по электронной структуре их атомов. Об электронной структуре атома, а значит, и о свойствах элемента судят по положению элемента в соответствующем периоде и подгруппе периодической системы. Закономерностями заполнения электронных уровней объясняется различное число элементов в периодах.