Периодическая система элементов (описание таблицы)
В настоящее время известно более 500 вариантов изображения периодической системы: это различные формы передачи периодического закона.
Первым вариантом системы элементов, предложенным Д.И. Менделеевым 1 марта 1869 г., был так называемый вариант длинной формы. В этом варианте периоды располагались одной строкой.
В декабре 1870 г. он опубликовал второй вариант периодической системы - так называемую короткую форму. В этом варианте периоды разбиваются на ряды, а группы - на подгруппы (главную и побочную).
В нашей стране наиболее распространен вариант короткой формы периодической системы как более компактный. Однако его существенный недостаток - сочетание в одной группе нескольких элементов, т.е. сильное различие элементов главных и побочных подгрупп. Это в какой-то мере "затушевывает" периодичность свойств элементов и затрудняет пользование системой. Поэтому в последнее стали часто применять, особенно в учебных целях, вариант длинной формы периодической системы Менделеева. Основной недостаток этого варианта - растянутость, не компактность (часть клеток системы пустует). Чтобы сделать ее более компактной, часто выносят лантаноиды из шестого и актиноиды из седьмого периодов, помещая их под системой отдельно. Такой вариант иногда называют полудлинным.
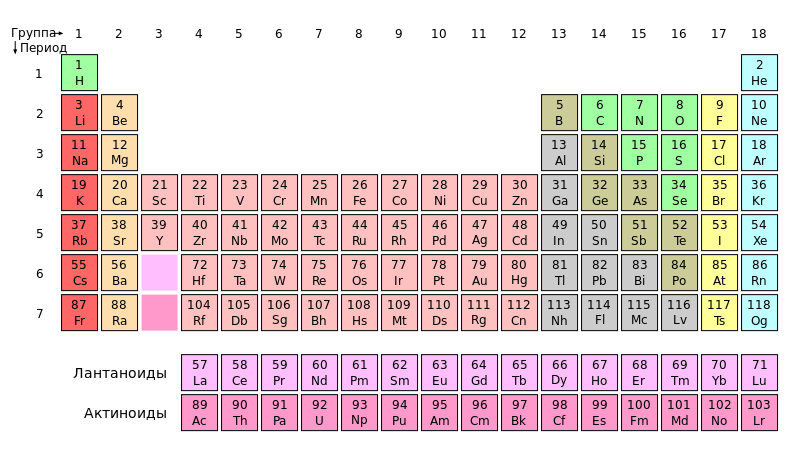
Короткий вариант периодической системы состоит из периодов, рядов и групп. Рассмотрим его несколько подробнее.
В периодической системе по горизонтали имеется 7 периодов, из них первые три называются малыми, а остальные - большими. В первом периоде находится 2 элемента, во втором и третьем - по 8, в четвертом и пятом - по 18, в шестом и седьмом - 32. Каждый период, за исключением первого, начинается щелочным металлом и заканчивается благородным газом.
Все элементы периодической системы пронумерованы в том порядке, в каком они следуют друг за другом. Номера элементов называются порядковыми или атомными номерами.
Элементы второго и третьего периодов Менделеев называл типическими. Свойства их закономерно изменяются от типичного металла до благородного газа. Закономерно изменяются в периодах и формы соединений элементов. Периодичности форм соединений Д.И. Менделеев придавал очень большое значение.
Каждый малый период состоит из одного ряда, каждый большой период - из двух рядов: четного (верхнего) и нечетного (нижнего). В четных рядах больших периодов (четвертом, шестом, восьмом и десятом) находятся одни металлы, и свойства элементов в ряду слева направо изменяются слабо. В нечетных рядах больших периодов свойства элементов в ряду слева направо изменяются, как у типических элементов.
Основным признаком, по которому элементы больших периодов разделены на два ряда, является их степень окисления (во времена Менделеева - валентность). Их одинаковые значения дважды повторяются в периоде с ростом атомных масс элементов. Например, в четвертом периоде степени окисления элементов от K до Mn изменяются от +1 до +7, затем следует триада Fe, Co, Ni (это элементы четного ряда), после чего наблюдается такое же возрастание степеней окисления от Cu до Br (это элементы нечетного ряда). То же мы видим в остальных больших периодах. Дважды повторяются в больших периодах и формы соединений элементов.
В шестом периоде вслед за лантаном располагаются 14 элементов с порядковыми номерами 58-71, называемых лантаноидами ("подобные лантану"). Лантаноиды помещены отдельно внизу таблицы. Химические свойства лантаноидов очень сходны. Например, все они являются реакционно-способными металлами, реагируют с водой с образованием гидроксида и водорода. Из этого следует, что у лантаноидов сильно выражена горизонтальная аналогия.
В седьмом периоде 14 элементов с порядковыми номерами 90-103 составляют семейство актиноидов ("подобные актинию"). Их также помещают отдельно - под лантаноидами. Однако в отличие от лантаноидов горизонтальная аналогия у актиноидов выражена слабо. Они в своих соединениях проявляют больше различных степеней окисления. Например, степень окисления актиния +3, а урана +3, +4, +5 и +6. Изучение химических свойств актиноидов крайне сложно вследствие неустойчивости их ядер.
В периодической системе по вертикали расположены восемь групп (обозначены римскими цифрами). Номер группы связан со степенью окисления элементов, проявляемой ими в соединениях. Как правило, высшая положительная степень окисления элементов равна номеру группы. Исключением является фтор - его степень окисления равна -1; медь, серебро, золото проявляют степень окисления +1, +2 и +3; из элементов VIII группы степень окисления +8 известна только для осмия, рутения, ксенона.
В VIII группе размещены благородные газы. Ранее считалось, что они не способны образовывать химические соединения. Но это не подтвердилось. В 1962 г. было получено первое химическое соединение благородного газа - тетрафторид ксенона XeF4.
Каждая группа делится на две подгруппы - главную и побочную, что в периодической системе подчеркивается смещением одних влево, а других вправо. Главную подгруппу составляют типические элементы (элементы второго и третьего периодов) и сходные с ними по химическим свойствам элементы больших периодов. Побочную подгруппу составляют только металлы - элементы больших периодов. VIII группа отличается от остальных. Кроме главной подгруппы гелия она содержит три побочные подгруппы: подгруппу железа, подгруппу кобальта и подгруппу никеля.
Химические свойства элементов главных и побочных подгрупп значительно различаются. Например, в VII группе главную подгруппу составляют неметаллы F, Cl, Br, I, At, побочную - металлы Mn, Tc, Re. Таким образом, подгруппы объединяют наиболее сходные между собой элементы.
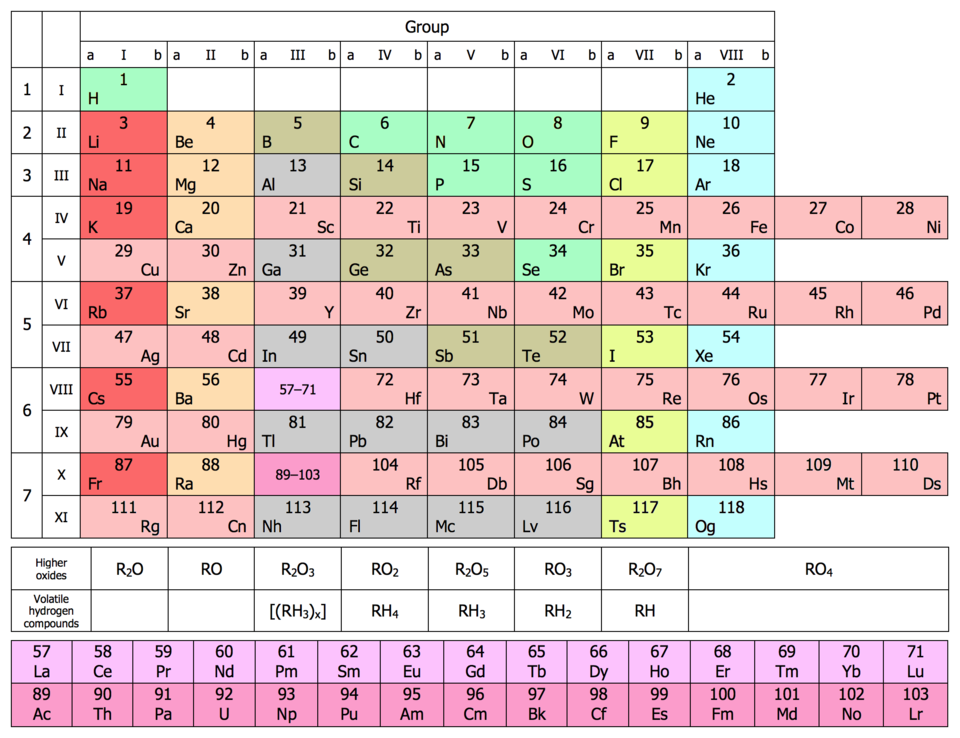
Все элементы, кроме гелия, неона и аргона, образуют кислородные соединения; существует всего 8 форм кислородных соединений. В периодической системе их часто изображают общими формулами, расположенными под каждой группой в порядке возрастания степени окисления элементов: R2O, RO, R2O3, RO2, R2O5, RO3, R2O7, RO4, где R - элемент данной группы. Формулы высших оксидов относятся ко всем элементам группы (главной и побочной), кроме тех случаев, когда элементы не проявляют степени окисления, равной номеру группы.
Элементы главных подгрупп, начиная с IV группы, образуют газообразные водородные соединения. Форм таких соединений 4. Их также изображают общими формулами в последовательности RH4, RH3, RH2, RH. Формулы водородных соединений располагаются под элементами главных подгрупп и только к ним относятся.
Свойства элементов в подгруппах закономерно изменяются: сверху вниз усиливаются металлические свойства и ослабевают неметаллические. Очевидно, металлические свойства наиболее сильно выражены у франция, затем у цезия; неметаллические - у фтора, затем - у кислорода.
Длинная форма периодической системы Менделеева также содержит 7 периодов и 18 групп. Лантаноиды, как и актиноиды, называют семейством и не относят к какой-либо группе.