Современная модель состояния электрона в атоме
При химических реакциях ядро атома не претерпевает изменений. Изменению подвергаются электронные оболочки атомов, строением которых объясняются многие свойства химических элементов. Поэтому состоянию электронов в атоме и структуре электронных оболочек всегда уделяется большое внимание при изучении химии.
Состояние электрона в атоме описывается квантовой механикой, которая изучает движение и взаимодействие микрочастиц, т.е. элементарных частиц, атомов, молекул и атомных ядер. По представлениям квантовой механики - микрочастицы имеют волновую природу, а волны обладают свойствами частиц. Применительно к электрону можно сказать, что он ведет себя и как частица и как волна, т.е. обладает, как и другие микрочастицы, корпускулярно-волновым дуализмом (двойственностью). С одной стороны, электроны как частицы производят давление, с другой стороны, движущийся поток электронов обнаруживает волновые явления, например дифракцию электронов.
Электрон в атоме не имеет траектории движения. Квантовая механика рассматривает вероятность нахождения электрона в пространстве вокруг ядра. Быстро движущийся электрон может находиться в любой части пространства, окружающего ядро, и различные положения его рассматриваются как электронное облако с определенной плотностью отрицательного заряда. Более наглядно это можно представить так. Если бы удалось через весьма малые промежутки времени получать снимок положения электрона в атоме (он отразится на нем в виде точки), то при наложении множества таких фотографий получилась бы картина электронного облака. И там, где число точек наибольшее, облако наиболее плотное. Максимальная плотность отвечает наибольшей вероятности нахождения электрона в данной части атомного пространства.
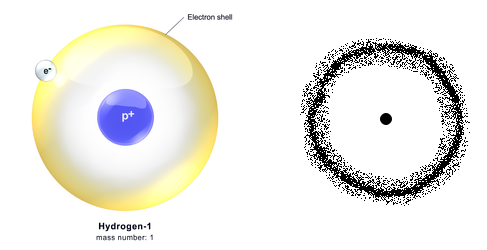
На рисунке справа изображена модель поперечного сечения атома водорода с точки зрения квантовой механики. Видно, что вблизи ядра электронная плотность практически равна нулю, т.е. электрон здесь почти не бывает. По мере удаления от ядра электронная плотность возрастает и достигает максимального значения на расстоянии 0,053 нм, а затем постепенно падает. Значит, наиболее вероятно нахождение движущегося электрона на расстоянии 0,053 нм от ядра (на рисунке более затемненные места). Чем прочнее связан электрон с ядром, тем более плотным по распределению заряда и меньшим по размерам должно быть электронное облако.
Пространство вокруг ядра, в котором наиболее вероятно нахождение электрона, называется орбиталью. Термин принят в 1962 г. взамен термина "орбита".
В орбитали заключено 90% электронного облака. Это означает, что около 90% времени электрон находится в этой части пространства. Орбитали атома имеют разные размеры. Очевидно, что электроны движущиеся в орбиталях меньшего размера, сильнее притягиваются ядром, чем электроны, движущиеся в орбиталях большего размера. Электроны, которые движутся в орбиталях близкого размера, образуют электронные слои. Электронные слои называют также энергетическими уровнями. Энергетические уровни нумеруют, начиная от ядра: 1, 2, 3, 4, 5, 6, 7. Иногда их обозначают буквами соответственно K, L, M, N, O, P, Q.
Целое число n, обозначающее номер уровня, называется главным квантовым числом. Оно характеризует энергию электронов, занимающих данный энергетический уровень. Наименьшей энергией обладают электроны первого энергетического уровня, наиболее близкого к ядру. По сравнению с электронами первого уровня электроны последующих уровней характеризуются большим запасом энергии. Очевидно, менее прочно связаны с ядром электроны внешнего уровня.
Число заполняемых электронами энергетических уровней в атоме численно равно номеру периода, в котором находится элемент: у атомов элементов первого периода - один энергетический уровень, второго периода - два, третьего периода - три и т.д. Наибольшее число электронов на энергетическом уровне равно удвоенному квадрату номера уровня, т.е.
N = 2n2,
где N - число электронов; n - номер уровня (считая от ядра) или главное квантовое число.
В соответствии с уравнением на 1-м, ближайшем к ядру энергетическом уровне может находиться не более двух электронов, на 2-м - не более 8, на 3-м - не более 18, на 4-м - не более 32.