Периодическая закон и периодическая система элементов в свете учения о строении атома
Учение о строении атома вскрыло глубокий физический смысл периодического закона.
Главной характеристикой атома является положительный заряд ядра. Это более общая и точная характеристика атома, а значит, и элемента. Заряд ядра определяет число электронов в электронной оболочке атома, ее строение, а тем самым все свойства элемента и его положение в периодической системе. В связи с этим претерпела изменение и формулировка закона.
Современная формулировка периодического закона Д.И. Менделеева такова:
Свойства химических элементов, а также формы и свойства соединений элементов находятся в периодической зависимости от заряда их атомов.
Такая формулировка закона нисколько не противоречит формулировке, данной Д.И. Менделеевым. Она только базируется на новых данных, которые придают закону и системе научную обоснованность и подтверждают их правильность. Периодическая система элементов Менделеева отражает периодический закон, а вместе с тем и строение атомов элементов.
Теория строения атомов объясняет периодическое изменение свойств элементов. Возрастание положительных зарядов атомных ядер от 1 до 118 обусловливает периодическое повторение строения внешнего энергетического уровня. А поскольку свойства элементов в основном зависят от числа электронов на внешнем уровне, то и они периодически повторяются. В этом физический смысл периодического закона.
В малых периодах с ростом положительного заряда ядер атомов возрастает число электронов на внешнем уровне (от 1 до 2 - в первом периоде, и от 1 до 8 - во втором и третьем периодах), что объясняет изменение свойств элементов: в начале периода (кроме первого) находится щелочной металл, затем металлические свойства постепенно ослабевают и усиливаются свойства неметаллические.
В больших периодах с ростом заряда ядер заполнение уровней электронами происходит сложнее, что объясняет и более сложное изменение свойств элементов по сравнению с элементами малых периодов. Так, в четных рядах больших периодов с ростом заряда число электронов на внешнем уровне остается постоянным и равно 2 или 1. Поэтому, пока идет заполнение электронами следующего за внешним (второго снаружи) уровня, свойства элементов в этих рядах изменяются крайне медленно. Лишь в нечетных рядах, когда с ростом заряда ядра увеличивается число электронов на внешнем уровне (от 1 до 8), свойства элементов начинают изменяться так же, как у типических.
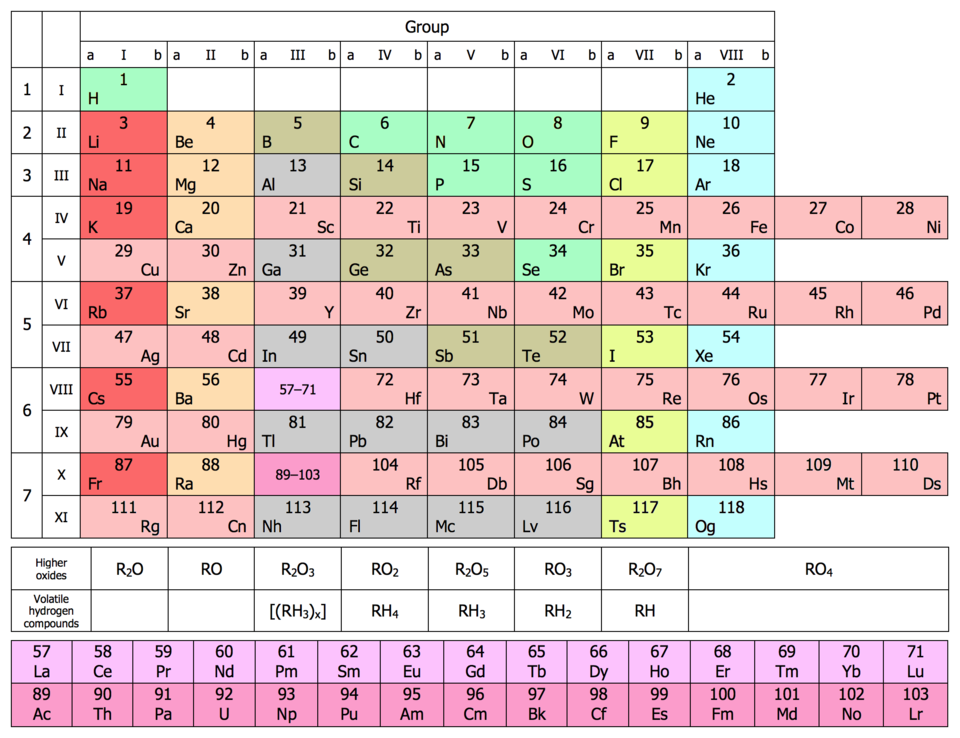
В варианте короткой формы периодической системы обычно выделяют ряды. Однако в настоящее время это понятие мало употребляется, поскольку не имеет физического смысла.
В свете учения о строении атома становится обоснованным разделение Д.И. Менделеевым всех элементов на семь периодов. Номер периода соответствует числу энергетических уровней атома, заполняемых электронами. Поэтому s-элементы имеются во всех периодах, p-элементы - во втором и последующих, d-элементы - в четвертом и последующих и f-элементы - в шестом и седьмом периодах.
Легко объяснимо и деление групп на подгруппы, основанное на различии в заполнении электронами энергетических уровней. У элементов главных подгрупп заполняются или s-подуровни (это s-элементы), или p-подуровни (это p-элементы) внешних уровней. У элементов побочных подгрупп заполняется d-подуровень второго снаружи уровня (это d-элементы). У лантаноидов и актиноидов заполняется соответственно 4f- и 5f-подуровни (это f-элементы). Таким образом, в каждой подгруппе объединены элементы, атомы которых имеют сходное строение внешнего электронного уровня. При этом атомы элементов главных подгрупп содержат на внешних уровнях число электронов, равное номеру группы. В побочные же подгруппы входят элементы, атомы которых имеют на внешнем уровне по два или по одному электрону.
Различия в строении обуславливают и различия в свойствах элементов разных подгрупп одной группы. Так, на внешнем уровне атомов элементов подгруппы галогенов имеется по семь электронов, а подгруппы марганца - по два. Первые - типичные неметаллы, а вторые - металлы.
Но у элементов этих подгрупп есть и общие свойства: вступая в химические реакции, все они (за исключением фтора F) могут отдавать по 7 электронов на образование химических связей. При этом атомы подгруппы марганца отдают 2 электрона с внешнего и 5 электронов со следующего за ним уровня. Таким образом, у элементов побочных подгрупп валентными являются электроны не только внешних, но и предпоследних (вторых снаружи) уровней, в чем состоит основное различие в свойствах элементов главных и побочных подгрупп.
Отсюда же следует, что номер группы, как правило, указывает число электронов, которые могут участвовать в образовании химических связей. В этом физический смысл номера группы.
Итак, строение атома обуславливает две закономерности: 1) изменение свойств элементов по горизонтали - в периоде слева направо ослабевают металлические и усиливаются неметаллические свойства; 2) изменение свойств элементов по вертикали - в подгруппе с ростом порядкового номера усиливаются металлические свойства и ослабевают неметаллические. В таком случае элемент (и клетка системы) находятся на пересечении горизонтали и вертикали, что определяет его свойства. Это помогает находить и описывать свойства элементов, изотопы которых получаются искусственным путем. Когда получают изотопы элементов восьмого периода, то их важнейшие химические свойства определяют по их месту в периодической системе. Представление о месте элемента в системе, которое определяется номерами периода и группы, впервые введено Д.И. Менделеевым.
С позиций строения атома объяснимо положение водорода в периодической системе. Атом водорода имеет один электрон, который может быть отдан атомам других элементов. Поскольку это свойство проявляют атомы всех элементов, начинающих периоды, — Li, Na, K, Rb, Cs, Fr, то и водород должен стоять в главной подгруппе I группы. С другой стороны, поскольку атом водорода обладает способностью, подобно атомам галогенов, присоединять один электрон (H + e- = H-), т.е. проявляет неметаллические свойства, он должен находиться в главной подгруппе VII группы. Такая двойственность в химическом проявлении водорода является причиной того, что его помещают в двух подгруппах. При этом в одной из подгрупп символ элемента заключают в скобки.
В четырех местах периодической системы элементы расположены не в порядке возрастания их атомных масс: Ar(39,948) — K(39,102); Co(58,933) — Ni(58,71); Te(127,60) — I(126,904); Th(232,038) — Pa(231). Эти отступления считали недостатками периодической системы. Учение о строении атома объяснило указанные отступления. Выше мы пришли к выводу, что свойства элемента зависят от величины положительного заряда ядра, а не от атомной массы. Опытное определение зарядов ядер указанных четырех пар элементов подтвердило, что Менделеев расположил их правильно.
18Ar — 19K; 27Co — 28Ni; 52Te — 53I; 90Th — 91Pa
Как же объяснить тот факт, что атомная масса аргона больше атомной массы калия (то же — для других пар)? Как известно, атомная масса элемента получается как среднее значение из массовых чисел его изотопов. Очевидно, атомная масса аргона в основном определяется изотопом с большим массовым числом (он встречается в природе в большем количестве), тогда как у калия преобладает изотоп с меньшим массовым числом. Таким образом, недостатков в периодической системе нет, и с точки зрения величины зарядов атомных ядер элементы расположены правильно.
Опытное определение заряда ядер элементов дало возможность число элементов между водородом и ураном, а также число лантаноидов. Ныне все места в периодической системе заполнены.