Электронные формулы
Распределение электронов в атоме по энергетическим уровням и подуровням изображают в виде электронных формул. Покажем, как они составляются.
Каждый электрон в атоме занимает свободную орбиталь с наиболее низкой энергией, отвечающей его прочной связи с ядром, — принцип наименьшей энергии. С ростом порядкового номера элемента электроны заполняют орбитали и уровни в порядке возрастания их энергий: уровни заполняются от первого к седьмому, а подуровни — в последовательности s — p — d — f. Последовательность возрастания энергий определена опытным путем. Она называется шкалой энергии. В соответствии с ней составляется ряд последовательного заполнения электронами орбиталей атомов элементов периодической системы. Этот ряд, в котором вертикальными линейками отделены периоды, обозначенные сверху цифрами, имеет вид
1 2 3 4 5 6 7 1s | 2s, 2p | 3s, 3p | 4s, 3d, 4p | 5s, 4d, 5p | 6s, 4f, 5d, 6p | 7s, 5f, 6d, 7p
Орбиталь с минимальной энергией — это 1s-орбиталь. У атома водорода она занята его единственным электроном. Поэтому электронная формула (или электронная конфигурация) атома водорода имеет вид: 1s1. Здесь число впереди — номер уровня, буквой выражается подуровень (тип орбитали), индекс справа вверху — число электронов на подуровне.
Поскольку на одной орбитали могут находиться два электрона, то оба электрона атома гелия размещаются на 1s-орбитали. Следовательно, электронная формула гелия 1s2. Электронная оболочка He завершена и очень устойчива, это благородный газ. У элементов второго периода заполняется L-уровень (n = 2), причем сначала орбиталь s-подуровня, а затем три орбитали p-подуровня. Третий электрон в атоме 3Li занимает 2s-орбиталь. Электронная формула Li: 1s22s1. Электрон 2s1 намного слабее связан с ядром атома, чем 1s-электроны, поэтому атом лития может легко его терять, образуя йон — Li+.
В атоме 4Be четвертый электрон также размещается на 2s-орбитали: 1s22s2. Легче других у Be отрываются два 2s-электрона с образованием иона Be2+.
Поскольку 2s-орбиталь заполнена, то пятый электрон у атома бора 5B занимает 2p-орбиталь. Электронная формула атома бора: 1s22s22p1.
Далее у атомов C, N, O, F идет заполнение 2p-орбиталей, которое заканчивается у атома Ne.
6C 1s22s22p2,
7N 1s22s22p3,
8O 1s22s22p4,
9F 1s22s22p5,
10Ne 1s22s22p6
Начиная с элементов третьего периода, у атомов идет заполнение третьего M-уровня, состоящего из 3s-, 3p- и 3d-подуровней. Например,
11Na 1s22s22p63s1,
17Cl 1s22s22p63s23p5
Иногда в формулах, изображающих распределение электронов в атомах, указывают только число электронов на каждом энергетическом уровне. Тогда их записывают так:
11Na - 2.8.1, 17Cl - 2.8.7, 26Fe - 2.8.14.2
При написании электронных формул следует учитывать так называемый "проскок" электрона. Так, электронная формула хрома должна быть 1s22s22p63s23p63d44s2. Однако на внешнем уровне у атома хрома не два электрона, а один - второй электрон "проскочил" на d-подуровень второго снаружи уровня. В таком случае расположение электронов у атома хрома такое: 1s22s22p63s23p63d54s1. То же имеет место у Nb, Mo и других элементов. У Pd электроны по уровням располагаются так: 2.8.18.18.0 (здесь пятый энергетический уровень вообще отсутствует - оба электрона "проскочили" на соседний уровень).
Очень часто структуру электронных оболочек изображают с помощью энергетических, или квантовых, ячеек - это так называемые графические электронные формулы. Каждая такая ячейка обозначается клеткой: клетка - орбиталь, стрелка - электрон, направление стрелки - направление спина, свободная клетка - свободная орбиталь, которую может занимать электрон при возбуждении. Согласно принципу Паули в ячейке может быть один или два электрона (если два электрона, то они спарены). Спин (в переводе с английского "веретено") упрощенно можно представить как вращение электрона вокруг собственной оси - по часовой и против часовой стрелки. Спаренными называют электроны с противоположными спинами.
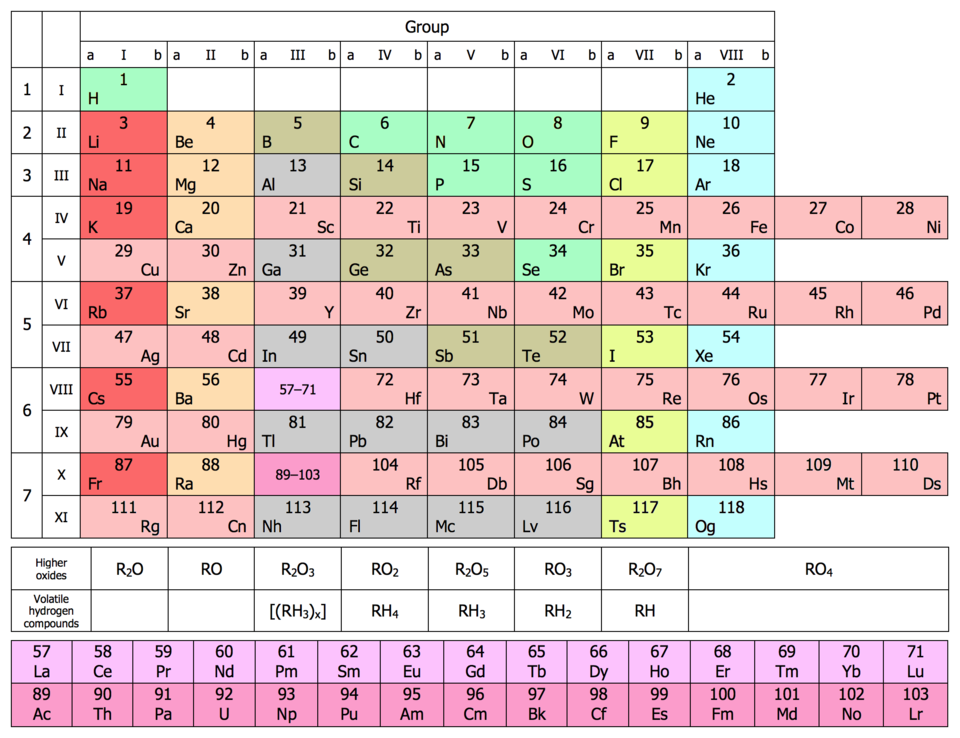
В качестве примера приведем схему распределения электронов по квантовым ячейкам в атоме углерода.
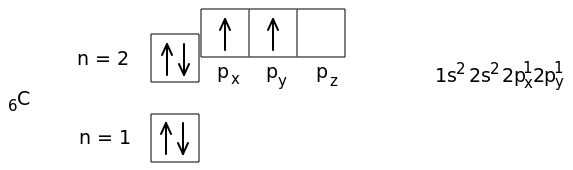
Орбитали подуровня заполняются так: сначала по одному электрону с одинаковыми спинами, а затем по второму электрону с противоположными спинами. Поскольку в 2p-подуровне три орбитали с одинаковой энергией, то каждый из двух 2p-электронов занял по одной орбитали (например, px и pу). Одна орбиталь осталась свободной (pz). У атома углерода два неспаренных электрона. В атоме азота все три 2p-орбитали (px, py, pz) заняты одиночными электронами.
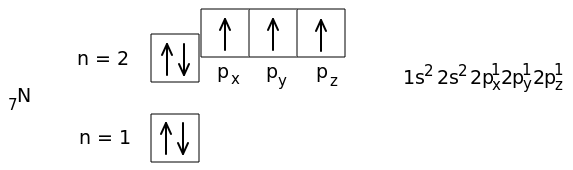
Следовательно, у него три неспаренных электрона. Это отражено и в подробной электронной формуле (справа от схемы).
Начиная с атома кислорода, 2p-орбитали заполняются вторым электроном с противоположным спином.
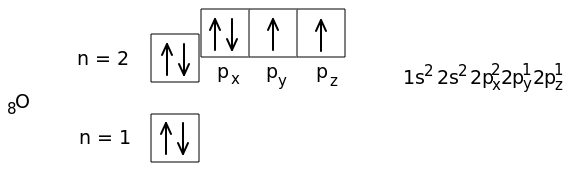
У атома кислорода два неспаренных электрона. У атома фтора - один неспаренный электрон.
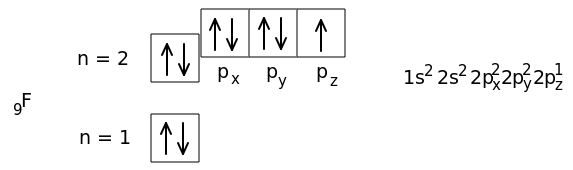
Таким образом, размещая электроны по квантовым ячейкам, можно выявить число неспаренных электронов в атоме. У атома Ne завершается заполнение второго уровня.
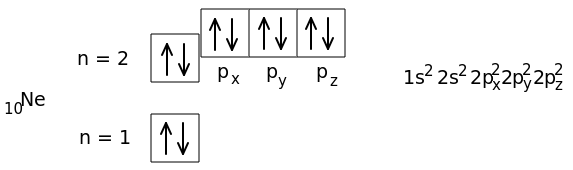
Восемь внешних электронов (s2p6) образуют очень устойчивую структуру из четырех двухэлектронных облаков. Все электроны у атома неона спарены. Неон - благородный газ.